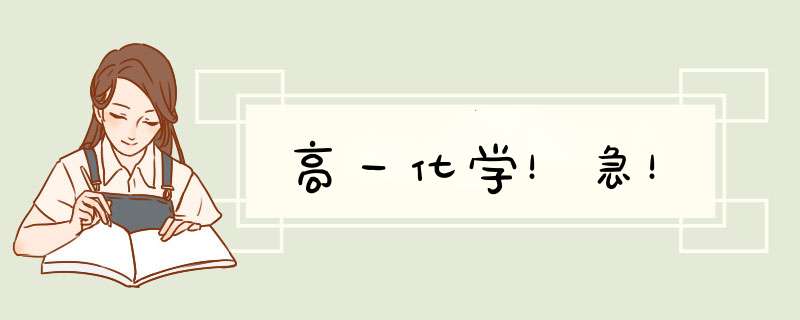
这道题首先应该写出碳酸氢铵在200℃分解的方程式
NH4HCO3 = NH3 + H2O +CO2
79 17 18 44
79g
由以上可以求出,生成氨气17克,水蒸气18克,二氧化碳44克。
(1)通过过氧化钠,水和过氧化钠反应生成氢氧化钠和氧气,二氧化碳和过氧化钠反应生成碳酸钠和氧气。增加的重量为2g+28g=30g。通过浓硫酸,氨气和硫酸反应生成硫酸氢铵无气体生成,氧气不被吸收,增加重量为17g。
(2)通过浓硫酸,水蒸气和氨气被吸收,无气体生成,增加重量为17+18=35g;通过过氧化钠,剩余的二氧化碳与过氧化钠反应生成碳酸钠和氧气,增加重量为44-16=28g。
质量守恒是肯定的 反应式左边质量必定等于右边质量 但是如果左右两边有气体生成时就要看情况 如果密闭rong器 一般质量不变 化学增重 减重什么的就无从谈起 如果是开放的话 气体跑掉了的话
利用前后质量差算出增重和减重
接下来的lz可以忽视 说到化学增重 我就想起熵和吉不斯函数 G=H-TS 在化学反应中也有这个函数 本来还有亥氏函数A 但是那个函数还衡量体积功 本来应该更准确 因为气体变化势必有体积功 但是考虑到lz应该还是高中生 就不探讨那个了 G这个函数衡量非体积功 如果外部的非体积功等于 G的变化量的话 那么可逆 所以考虑一个化学式可逆不可逆用这个就可以
把CO2看成COO
2Na2O2+2CO2=2Na2CO3+O2
就可以看成Na2O2+CO=Na2CO3增的重就是CO的质量
同理H20看成H2,增重也就是H2的质量
答案:c。
我昨天刚给我们学生讲了。
直接做就是列方程式做,
简便算法是,增重多少,一氧化碳的质量就是多少,所以,这道题一氧化碳14克,氧气就是12克,7:6
分析一下,按照碳原子守恒。过氧化钠最后生成了碳酸钠,看看增加的是什么:Na2O2到Na2CO3碳酸钠比过氧化钠多出来的就是一个C一个O。相当于一个CO,这个反应可以认为(注意只是认为,不是真实的反应。)Na2O2+CO=Na2CO3
所以,规律:增加的就是CO的质量。
类似的还有,氢气也这样,氢气有多少,过氧化钠就增加多少,生成的是氢氧化钠。
答案是c
第一步:确定9gA中含有的C、H、O的含量,通过浓硫酸吸收水,碱石灰能吸收水和CO2,但水已经被浓硫酸吸收了,那么54g是燃烧生成的水的质量,132g是生成二氧化碳的质量,根据比例可知其中碳元素质量为36g,氢元素质量为06g,总质量为9g,则氧元素的质量为48g。
第二步:确定A中C、H、O的物质的量的比与A的分子式。C:H:O=(36/12):(06/1):(48/16)=1:2:1 而相对分子质量为90,可以确定A的分子式是C3H6O3
第三步:确定A中的功能团。 A能与NaHCO3溶液发生反应,说明A中有酸性比石碳酸(碳酸氢根)酸性强的,有机物中只有羧基—COOH;2分子A之间脱水可生成六元环化合物,经验可知此处发生的是酯化反应,A中必须含有羟基—OH,所以可以推得A的结构简式为:
HO-CH-CH2-COOH
答案:A错了,其中不含有醛基,B也错了;A中能与na反应的有羟基和羧基,即01molA能与02molNa发生反应,生成01mol的H2,换算成标况体积刚好是224L,所以选C
嗯,重力做的功小组不是老师…
遇到这样的题应该先判断碱石灰吸收的到底是什么,因为有的题目中可能根本就没有二氧化碳或者水的生成,所以要先弄清这个……
如果都有的话,依然可以用质量守恒定律,因为这是正确的,但是要注意是不是在吸收过程中还有其他的气体或固体或液体也生成但没有被吸收?如果这一点不计算的话质量就不能守恒了。这些都计算过之后,就要看是否学过“物质的量”这一概念了,一般用物质的量来计算会比较简便,但初中不学习,所以只能用质量和相对分子质量来计算。
至于写不写方程式,如果是填空题,计算过程在草稿纸上,那么写不写都可以,熟练了以后可以不写,但如果是一道简答题,就应该认真考虑一下是否要写了……
欢迎分享,转载请注明来源:浪漫分享网

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)