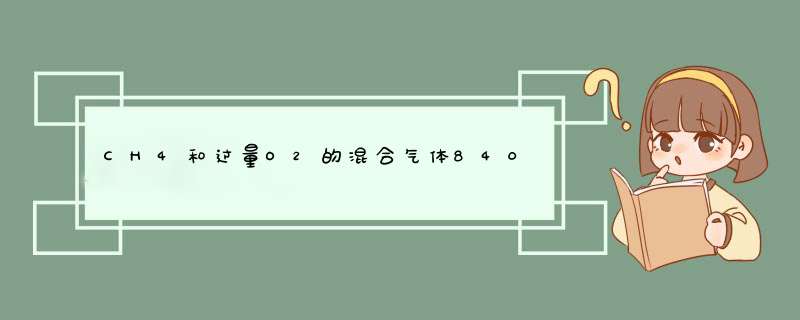
00075 mol 0336L
设n(CH4)=xmol,n(CO2)=xmol,,n(H2O)=2xmol,通过碱石灰增重的就是二氧化碳和水的质量。所以44x+36x=06 x=00075 mol 原混合气体中的CH4物质的量为00075 mol
通过足量碱石灰后剩余气体的体积为O2,所以剩下的氧气为(0084/224-00075-000752)224=0336L
将此混合气体通过浓硫酸,浓硫酸增重54g,说明生成03摩尔水(含06摩尔氢原子和03摩尔氧原子)
最后通过足量碱石灰,碱石灰增重88g说明最后生成02摩尔二氧化碳,即有02摩尔碳原子及04摩尔氧原子
再通过灼热氧化铜粉末,氧化铜质量减少16g;说明有01摩尔氧原子被一氧化碳夺走,那就是生成01摩尔一氧化碳和01摩尔二氧化碳。最后的二氧化碳中有01摩尔氧原子来源于氧化铜。
56升氧气是025摩尔,含05摩尔氧原子,而燃烧生成的一氧化碳、二氧化碳和水一共有氧原子06摩尔,所以01摩尔有机物含01摩尔氧原子。
因此,有机物分子式是:C2H6O。
经过浓硫酸后,产物质量减轻108g。生成水108g÷18g/mol=06mol
通过灼烧的CUO,充分反应后,产物质量增加了32g。
CO+CuO=CO2+Cu 气体增重
28。。。。。。。。。。。。。16
x。。。。。。。。。。。。。32g
生成一氧化碳x=56g
56g÷28g/mol=02mol
最后气体在通过碱石灰时被完全吸收,碱石灰增重176g即二氧化碳
176g÷44g/mol=04mol
燃烧时产生的二氧化碳04mol-02mol=02mol
所以,02mol有机物含碳04mol,
含氢06mol×2=12mol
含氧一氧化碳的氧+二氧化碳的氧+水的氧-反应物的氧
02mol+02mol×2+06mol-05mol×2=02mol
1mol有机物含碳2mol、氢6mol、氧1mol
C2H6O
(2)应该不难吧?
乙醇C2H5OH
有机物含C、H、O
碳通过最后的碱石灰增重来算。264/44=06
氢通过硫酸增重来算162/18=09 092=18
氧的来源可以这样看,刚开始有06mol氧气,以及有机物中不知量的摩尔数,和吸收过程中cuo减少的质量也是氧原子。
最后的话,有co2,h20就没其他了。所以原先有机物中的氧的量为062+09-062-48/16=06
C2H6O2是乙二醇
浓硫酸增重9克,说明生成水的质量为9g
H2O -----2H
18 2mol
9 1mol
碱石灰增重264克说明CO2质量为264g
CO2-----C
44 1mol
264 06mol
说明了01mol某气态烃A含1molH和06molC
烃A的分子式C6H10
烃A的一种同分异构体,其一氯代物只有一种,写出该同分异构体,的结构简式: 好像没有啊
分析:标况下840ml的CH4与O2,一共00375mol(84/224=00375)甲烷的相对分子量为16,氧气的为32,一个甲烷分子完全燃烧用掉两个氧气分子,设原气体中甲烷有x mol,那么消耗的氧气就有2xmol,生成的气体全部被碱石灰吸收,因而可以通过增重的质量求出原来甲烷的物质的量
16x+64x=06g
x=00075mol
由此可算出甲烷的体积(STP)为00075224=0168L=168ml
反应的氧气为336ml
剩下的气体为840ml-336ml-168ml=336ml
--------------------------------------------
上面是第一问
---------------------------------------------
下面第二问,既然在第一问求出甲烷的体积了,那剩下的就全是氧气的,
因而氧气有840ml-168ml=672ml
因而原混合气体中CH4和O2的体积比为1/4
思路应该是这样,从质量与反应方程式入手,设个未知数,然后就出来了
2NaOH+CO2==Na2CO3+H2O
其中只有CO2为气体,生成物中的水没有挥发,留了下来,由质量守恒定律可知,生成物质量为CO2与NaOH质量之和,因此增加的88g即为CO2质量。
欢迎分享,转载请注明来源:浪漫分享网

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)