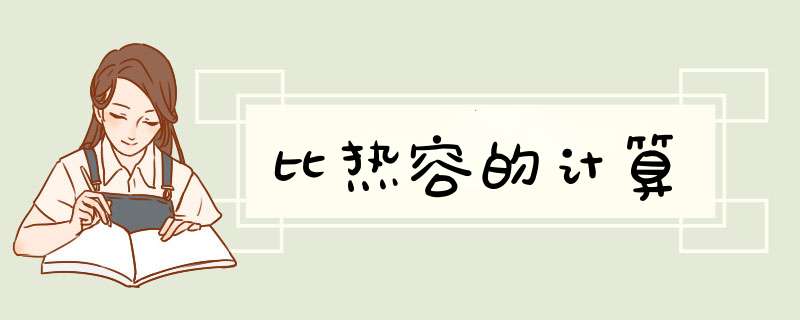
Q=cm△t。
1、定义:一定质量的某种物质,在温度升高(或降低)时吸收(或放出)的热量与它的质量和升高(或降低)的温度的乘积之比,叫做这种物质的比热容。比热容用c表示,单位:焦/(千克·摄氏度)符号:J/(kg·C)表示。
2、特点(1)比热容是物质的一种特性,每种物质都有自己的比热容,不同物质的比热容一般不同,可以粗略鉴别物质。(2)比热容的大小只取决于物质本身及状态,与质量大小、温度高低、吸放热量多少无关。(3)物质的比热容越大,其温度越不容易改变。
水的比热容:c水=42×103J/(kg·C)。物理意义:质量为1kg的水温度升高或降低1℃时,吸收或放出的热量为42×103J。
比热容(specific heat capacity)又称比热容量,简称比热(specific heat),是单位质量物质的热容量,即使单位质量物体改变单位温度时的吸收或释放的内能比热容是表示物质热性质的物理量通常用符号c表示
目录
定义
单位
计算基本计算
混合物的比热容:
气体的比热容
比热表:常见物质的比热容
常见气体的比热容
水的比热容较大这一性质的应用一、利用水的比热容大来调节气候
二、利用水的比热容大来冷却或取暖
定义
单位
计算 基本计算
混合物的比热容:
气体的比热容
比热表:常见物质的比热容
常见气体的比热容
水的比热容较大这一性质的应用 一、利用水的比热容大来调节气候
二、利用水的比热容大来冷却或取暖
展开 编辑本段定义
物质的比热容与所进行的过程有关在工程应用上常用的有定压比热容Cp、定容比热容Cv和饱和状态比 比热容测试仪
热容三种 定压比热容Cp是单位质量的物质在压力不变的条件下,温度升高或下降1℃或1K所吸收或放出的能量 定容比热容Cv是单位质量的物质在容积(体积)不变的条件下,温度升高或下降1℃或1K吸收或放出的内能 饱和状态比热容是单位质量的物质在某饱和状态时,温度升高或下降1℃或1K所吸收或放出的热量 在中学范围内,简单(不严格)的定义为: 单位质量的某种物质温度升高1℃所吸收的热量(或降低1℃所释放的热量)叫做这种物质的比热容 比热容用符号c表示
编辑本段单位
比热的单位是复合单位 在国际单位制中,能量、功、热量的主单位统一为焦耳,温度的主单位是开尔文,因此比热容的主单位为J/(kg·K),读作“焦[耳]每千克开[尔文]”([]内的字可以省略) 常用单位:kJ/(kg·℃)、cal/(kg·℃)、kcal/(kg·℃)等注意摄氏度和开尔文仅在温标表示上有所区别,在表示温差的量值意义上等价,因此这些单位中的℃和K可以任意互相替换例如“焦每千克摄氏度”和“焦每千克开”是等价的
编辑本段计算
基本计算
设有一质量为m的物体,在某一过程中吸收(或放出)热量ΔQ时,温度升高(或降低)ΔT,则ΔQ/ΔT称为物体在此过程中的热容量(简称热容),用C表示,即C=ΔQ/ΔT用热容除以质量,即得比热容c=C/m=ΔQ/mΔT对于微小过程的热容和比热容,分别有C=dQ/dT,c=1/mdQ/dT因此,在物体温度由T1变化到T2的有限过程中,吸收(或放出)的热量Q=∫(T2,T1)CdT=m∫(T2,T1)cdT 一般情况下,热容与比热容均为温度的函数,但在温度变化范围不太大时,可近似地看为常量于是有Q=C(T2-T1)=mc(T2-T1)如令温度改变量ΔT=T2-T1,则有Q=cmΔT这是中学中用比热容来计算热量的基本公式 在英文中,比热容被称为:Sepcific Heat Capacity(SHC) 用比热容计算热能的公式为:Energy=Mass×Specific Heat Capacity×Temperature change 可简写为:Energy=Mass×SHC×Temp Ch,Q=mcΔt 与比热相关的热量计算公式:Q=cmΔt 即Q吸(放)=cm(t-t1) 其中c为比热,m为质量,t为末温,t1为初温,Q为能量吸热时为Q=cmΔt升(用实际升高温度减物体初温),放热时为Q=cmΔt降(用实际初温减降后温度)或者Q=cmΔt=cm(t末-t初),Q>0时为吸热,Q
比热容
(specific
heat
capacity)
又称
比
热容量
,简称
比热
(specific
heat)
,是
单位质量物质的热容量
,即
使单位质量物体改变单位温度时的吸收或释放的内能
。比热容是表示物质热性质的物理量。通常用符号c表示。
物质的比热容与所进行的过程有关。在工程应用上常用的有定压
比热容C
p、定容比热容Cv和
饱和状态
比热容三种,定压比热容Cp是单位质量的物质在比压不变的条件下,温度升高或下降1℃或1K所吸收或放出的能量;定容比热容Cv是单位质量的物质在
比容
不变的条件下,温度升高或下降1℃或1K吸收或放出的内能,饱和状态比热容是单位质量的物质在某饱和状态时,温度升高或下降1℃或1K所吸收或放出的热量。
在中学范围内,简单(不严格)的定义为:
单位质量的某种物质温度升高1℃吸收的热量(或降低1℃释放的热量)叫做这种物质的比热容。
[编辑本段]单位 比热的单位是复合单位。
在
国际单位制
中,能量、功、热量的主单位统一为
焦耳
,温度的主单位是
开尔文
,因此比热容的主单位为
J/(kg·K)
,读作“焦[耳]每千克开”。([]内的字可以省略。)
常用单位
:kJ/(kg·℃)、cal/(kg·℃)、kcal/(kg·℃)等。注意
摄氏度
和开尔文仅在温标表示上有所区别,在表示温差的量值意义上等价,因此这些单位中的℃和K可以任意互相替换。例如“
焦每千克摄氏度
”和“焦每千克开”是等价的。
[编辑本段]计算基本计算 设有一质量为m的物体,在某一过程中吸收(或放出)热量ΔQ时,温度升高(或降低)ΔT,则ΔQ/ΔT称为物体在此过程中的热容量(简称热容),用C表示,即C=ΔQ/ΔT。用热容除以质量,即得比热容c=C/m=ΔQ/mΔT。对于微小过程的热容和比热容,分别有C=dQ/dT,c=1/mdQ/dT。因此,在物体温度由T1变化到T2的有限过程中,吸收(或放出)的热量Q=∫(T2,T1)CdT=m∫(T2,T1)CdT。
一般情况下,热容与比热容均为温度的函数,但在温度变化范围不太大时,可近似地看为常量。于是有Q=C(T2-T1)=mc(T2-T1)。如令温度改变量ΔT=T2-T1,则有Q=cmΔT。这是中学中用比热容来计算热量的基本公式。
在英文中,比热容被称为:Sepcific
Heat
Capacity(SHC)。
用比热容计算热能的公式为:Energy=Mass×Specific
Heat
Capacity×Temperature
change
可简写为:Energy=Mass×SHC×Temp
Ch,
Q=mcΔt
。
与比热相关的
热量计算公式
:Q=cmΔt
即Q吸(放)=cm(t-t1)
其中c为比热,m为质量,t为末温,t1为
初温
,Q为能量。
吸热时为Q=cmΔt升(用实际升高温度减物体初温),放热时为Q=cmΔt降(用实际初温减降后温度)。或者Q=cmΔt=cm(t末-t初),Q>0时为吸热,Q<0时为放热。
欢迎分享,转载请注明来源:浪漫分享网

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)