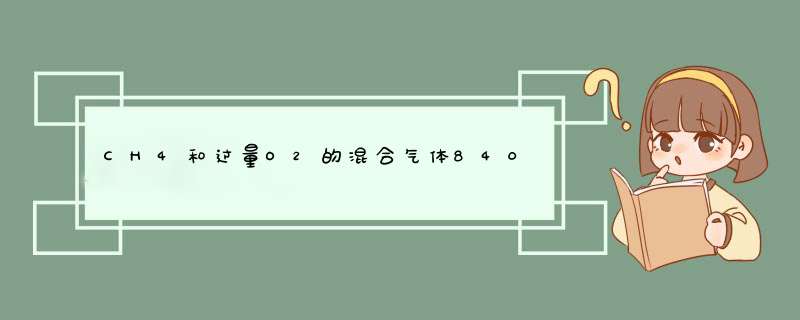
00075 mol 0336L
设n(CH4)=xmol,n(CO2)=xmol,,n(H2O)=2xmol,通过碱石灰增重的就是二氧化碳和水的质量。所以44x+36x=06 x=00075 mol 原混合气体中的CH4物质的量为00075 mol
通过足量碱石灰后剩余气体的体积为O2,所以剩下的氧气为(0084/224-00075-000752)224=0336L
(1)某烃A 002mol在氧气中充分燃烧后,生成物依次通过浓硫酸和碱石灰,浓硫酸质量增加18g为水的质量,水的物质的量=
| 18g |
| 18g/mol |
| 44g |
| 44g/mol |
| 01mol |
| 002mol |
| 01mol×2 |
| 002mol |
故答案为:C5H10;
(2)烃C5H10完全燃烧生成二氧化碳与水,化学方程式为:2C5H10+15O2
| 点燃 |
故答案为:2C5H10+15O2
| 点燃 |
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,则A含有1个C=C双键,其加成产物分子中含有3个甲基,故加成产物为异戊烷,则A可能的结构简式为:、、;
以上结构简式中,可以看作甲基取代了乙烯中的三个氢原子,所有其分子中所有碳原子共平面,其用键线式为:,发生加聚反应的方程式为:,
故答案为:、、(任意两种);;.
浓硫酸增重可知水的质量为144g,可计算出n(H2O)=
| 144g |
| 18g/mol |
碱石灰增重264g为二氧化碳的质量,二氧化碳的物质的量为,n(CO2)=n(C)=
| 264g |
| 44g/mol |
m(C)+m(H)=88g,有机物的质量为12g,则有机物中一定含有氧元素,
12g有机物中含有的氧的质量为:12g-88g=32g,n(O)=
| 32g |
| 16g/mol |
则:n(C):n(H):n(O)=06mol:16mol:02mol=3:8:1,即实验式为C3H8O,
由于C3H8O中碳原子已经饱和,所以该有机物的分子式也为:C3H8O;
分子式为C3H8O的有机物可能为丙醇或甲乙醚,可能的结构简式为:CH3CH2CH2OH、CH3CH(OH)CH3、CH3OCH2CH3,
答:该有机物的分子式为C3H8O,它的各种同分异构体的结构简式为CH3CH2CH2OH、CH3CH(OH)CH3、CH3OCH2CH3.
浓硫酸增重为水的重量54g,03mol,通过碱石灰重为二氧化碳88g,02mol,根据原子守恒,01mol的碳氢化合物产生03mol水,02mol二氧化碳,也就是1mol化合物产生3mol水,2mol二氧化碳,综合起来有6个H和2个C,所以是C2H6
测得化合物的蒸汽对乙醇的相对密度是2,可知其M=92,则92g该物质为01mol
将生成的产物先通过浓硫酸增重72g,后通过碱石灰增重132g,可知水的量为04mol,二氧化碳为03mol
这样就可以确定每个A分子中含有8个氢,3个碳,未知个氧
氧可以根据分子量来计算,92=8+36+16x
x=3
所以其分子式为C3H8O3
欢迎分享,转载请注明来源:浪漫分享网

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)